7 8 2465 Pengertian Asam Karboksilat, Sifat, Kegunaan, Isomer, Dampak, Bahaya, Pembuatan, Sintesis, Kimia
Pengertian Asam Karboksilat,
Sifat, Kegunaan, Isomer, Dampak, Bahaya, Pembuatan, Sintesis, Kimia -
Asam karboksilat (R–CO–OH) mengandung gugus karbonil dan gugus
hidroksil. Walaupun gugus karboksilat merupakan gabungan gugus karbonil
dan gugus hidroksil, tetapi sifat-sifat gugus tersebut tidak muncul
dalam asam karboksilat karena menjadi satu kesatuan dengan ciri
tersendiri. Ester adalah turunan dari asam karboksilat dengan mengganti
gugus hidroksil oleh gugus alkoksi dari alkohol.
Asam karboksilat memiliki gugus fungsional karboksil (–COOH) dengan rumus umum :
Beberapa contoh asam karboksilat adalah sebagai berikut.
a. Aturan Penamaan / Tata Nama Asam Karboksilat
Asam asetat merupakan senyawa pertama yang ditemukan dari golongan asam
karboksilat. Oleh sebab itu, penataan nama asam karboksilat umumnya
diambil dari bahasa Latin berdasarkan nama sumbernya di alam.
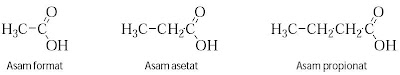
Asam format (formica, artinya semut) diperoleh melalui distilasi semut,
asam asetat (acetum, artinya cuka) dari hasil distilasi cuka, asam
butirat (butyrum, kelapa) ditemukan dalam santan kelapa, dan asam
kaproat (caper, domba) diperoleh dari lemak domba.
Menurut sistem IUPAC, penataan nama asam karboksilat diturunkan dari
nama alkana, di mana akhiran -a diganti -oat dan ditambah kata asam
sehingga asam karboksilat digolongkan sebagai alkanoat. Beberapa nama
asam karboksilat ditunjukkan pada Tabel 1.
Tabel 1. Penataan Nama Asam Karboksilat Menurut Trivial dan IUPAC
Rumus
|
Nama Trivial
|
Nama IUPAC
|
H–COOH
|
Asam format
|
Asam metanoat
|
CH3–COOH
|
Asat asetat
|
Asam etanoat
|
CH3–CH2–COOH
|
Asam propionat
|
Asam propanoat
|
CH3–(CH2)2–COOH
|
Asam butirat
|
Asam butanoat
|
CH3–(CH2)3–COOH
|
Asam valerat
|
Asam pentanoat
|
CH3–(CH2)4–COOH
|
Asam kaproat
|
Asam heksanoat
|
CH3–(CH2)5–COOH
|
Asam enantat
|
Asam heptanoat
|
CH3–(CH2)6–COOH
|
Asam kaprilat
|
Asam oktanoat
|
CH3–(CH2)7–COOH
|
Asam pelargonat
|
Asam nonanoat
|
CH3–(CH2)8–COOH
|
Asam kaprat
|
Asam dekanoat
|
Pemberian nomor atom karbon pada asam karboksilat menurut sistem IUPAC
dimulai dari atom karbon gugus karbonil dengan angka 1,2,3, dan
seterusnya. Adapun trivial menggunakan huruf unani, seperti α, β, γ dan
dimulai dari atom karbon nomor 2 dari sistem IUPAC. Contoh penataan nama
asam karboksilat :
Untuk gugus karboksil yang terikat langsung pada gugus siklik, penataan
nama dimulai dari nama senyawa siklik diakhiri dengan nama karboksilat,
seperti ditunjukkan berikut ini.
Contoh Soal Penamaan Asam Karboksilat (1) :
Tuliskan nama untuk asam karboksilat berikut.
Jawaban :
Rantai induk mengandung enam atom karbon atau suatu heksanoat.
Pada atom nomor 2 terikat gugus metil, dan pada atom nomor 4 terikat gugus etil. Jadi, nama asam karboksilat tersebut adalah
IUPAC : asam 4–etil–2–metilheksanoat
Trivial : asam γ–etil–α–metil–kaproat
Suatu asam karboksilat dapat memiliki dua gugus fungsi CO2H, dikenal
sebagai dikarboksilat. Beberapa asam dikarboksilat ditunjukkan pada
Tabel 2. Senyawa-senyawa tersebut diisolasi dari bahan alam. Asam
tartrat misalnya, adalah hasil samping fermentasi anggur; asam suksinat,
asam fumarat, asam malat, dan oksalo asetat adalah zat antara dalam
metabolisme karbohidrat di dalam sistem sel.
Tabel 2. Tata Nama Asam Dikarboksilat (Trivial dan IUPAC)
Rumus
Struktur
|
Nama
Trivial
|
Nama
IUPAC
|
HOOC–COOH
|
Asam
oksalat
|
Asam
etanadioat
|
HOOC–CH2–COOH
|
Asam
malonat
|
Asam
propanadioat
|
HOOC–(CH2)2–COOH
|
Asam
suksinat
|
Asam
butanadioat
|
cis–HOOC–CH=CH–COOH
|
Asam
maleat
|
Asam
cis–butenadioat
|
trans–HOOC–CH=CH–COOH
|
Asam
fumarat
|
Asam
trans–butenadioat
|
HOOC–(CH2)4–COOH
|
Asam
adipat
|
Asam
heksanadioat
|
Beberapa asam trikarboksilat juga dikenal dan berperan penting dalam
metabolisme karbohidrat. Contoh senyawa kelompok ini adalah asam sitrat.
Rumus strukturnya seperti berikut.
b. Sifat dan Kegunaan Asam Karboksilat
Dua asam karboksilat paling sederhana adalah asam metanoat dan asam
etanoat, masing-masing memiliki titik didih 101 °C dan 118 °C. Tingginya
titik didih ini disebabkan oleh adanya tarik menarik antar molekul asam
membentuk suatu dimer.
Ditinjau dari gugus fungsionalnya, asam karboksilat umumnya bersifat
polar, tetapi kepolaran berkurang dengan bertambahnya rantai karbon.
Makin panjang rantai atom karbon, makin berkurang kepolarannya,
akibatnya kelarutan di dalam air juga berkurang.
Sebagaimana alkohol, empat deret pertama asam karboksilat (format,
etanoat, propanoat, dan butanoat) dapat larut baik di dalam air. Asam
pentanoat dan heksanoat sedikit larut, sedangkan asam karboksilat yang
rantai karbonnya lebih panjang tidak larut.
 |
| Gambar 1. Kegunaan asam karboksilat. |
Asam karboksilat juga dapat larut di dalam pelarut yang kurang polar,
seperti eter, alkohol, dan benzena. Kelarutan di dalam pelarut kurang
polar ini makin tinggi dengan bertambahnya rantai karbon. Oleh karena
itu, lemak dapat larut di dalam benzena dan eter (lemak adalah ester
dari asam karboksilat).
Akibat kepolaran dan struktur dimer dari molekul asam karboksilat
menimbulkan titik didih dan titik beku lebih tinggi dibandingkan alkohol
dengan massa molekul yang relatif sama. Titik beku dan titik didih dari
asam karboksilat ditunjukkan pada Tabel 3.
Tabel 3. Titik Beku dan Titik Didih Asam Karboksilat
Senyawa
|
Titik Beku (°C)
|
Titik Didih (°C)
|
Format
|
8
|
100,5
|
Asetat
|
16,6
|
118
|
Propionat
|
–22
|
141
|
Butirat
|
–6
|
164
|
Valerat
|
–34
|
187
|
Kaproat
|
–3
|
205
|
Laurat
|
44
|
225
|
Miristat
|
54
|
251
|
Palmitat
|
63
|
269
|
Stearat
|
70
|
287
|
Senyawa utama asam karboksilat yang dibuat secara besar-besaran adalah
asam metanoat, asam etanoat, dan asam propanoat (Gambar 6.19). Asam
metanoat berwujud cair dan berbau tajam. Asam ini dapat mengakibatkan
kulit melepuh, kayu menjadi lapuk, dan besi mudah berkarat. Asam
metanoat digunakan untuk peracikan obat (aspirin), menggumpalkan getah
karet (lateks), dan membasmi hama.
Asam metanoat atau asam asetat berbau menyengat. Dengan bertambahnya
panjang rantai, bau asam karboksilat menjadi lebih tidak disukai.
Contohnya, asam butirat ditemukan dalam keringat manusia yang berbau
tidak sedap.
Asam asetat (cuka) berwujud cair dan berbau menyengat. Wujud asam asetat
murni menyerupai es, disebut sebagai asam asetat glasial. Asam asetat
digunakan untuk selulosa, bumbu dapur, penahan warna agar tidak mudah
luntur, pembuatan cat, dan pelarut. Asam benzoat (asam karboksilat
aromatik) digunakan sebagai bahan pengawet pada makanan, seperti kecap,
saos tomat, dan minuman dari buah-buahan.
Jeruk mengandung asam sitrat dapat digunakan untuk membersihkan karat pada besi.
c. Pembuatan Asam Karboksilat
Asam karboksilat dapat dibuat dengan cara oksidasi alkohol atau hidrolisis senyawa nitril.
1) Oksidasi Alkohol Primer
Asam karboksilat biasanya diperoleh melalui oksidasi alkohol primer
dengan suatu oksidator yang kuat, seperti natrium dikromat dalam asam
sulfat pekat. Persamaan kimianya :
3R–CH2OH + 2Cr2O72– + 16H+
→ 3R–COOH + 4Cr3+ + 11H2O
2) Hidrolisis Nitril (Sianida Organik)
Apabila alkil sianida (nitril) dididihkan dengan katalis asam atau basa
akan terbentuk asam karboksilat. Pada reaksi ini terbentuk amonia.
Persamaan kimianya :
R–CN + 2H2O + HCl → R–COOH + NH3 + HCl
 |
| Gambar 2. Percobaan pembuatan cuka di laboratorium. |
Contoh Soal Kelarutan Asam Karboksilat di Dalam Air (2) :
Di antara isomer karboksilat berikut, mana yang memiliki kelarutan paling tinggi di dalam pelarut air dan di dalam benzena?
a. asam pentanoat
b. asam 2–metilbutanoat
c. asam 3–metilbutanoat
d. asam 2,2–dimetil propanoat
Pembahasan :
Makin banyak cabang pada rantai induk (asam 2,2–dimetil propanoat) makin
kurang kepolaran. Oleh karena itu, kelarutannya di dalam air paling
kecil, tetapi kelarutan di dalam benzena paling besar. Jadi, kelarutan
paling tinggi di dalam air adalah asam pentanoat.
Vitamin C
Prioritas pengembangan kimia organik pada abad ke–20 hanya pada zat yang
bersumber dari alam. Zat-zat tersebut dinamakan produk alami, yang
pertama kali digunakan tanpa pengetahuan komposisi kimianya. Seperti
vitamin C yang berasal dari buah lemon dan sitrus lainnya, baru
diketahui struktur kimianya pada tahun 1933. Struktur vitamin C adalah
senyawa organik asam karboksilat, yaitu asam askorbat, dengan struktur
molekul seperti berikut.
Pada saat struktur kimia vitamin C diketahui, Kimiawan Organik berusaha
mensintesis senyawa tersebut. Pada tahun 1933, sintesis vitamin C dapat
dilakukan secara lengkap. Sintesis vitamin C dari glukosa lebih murah
daripada mengekstraknya dari sitrus atau sumber alami lainnya.
Di seluruh dunia, lebih dari 80 juta pon vitamin C disintesis setiap
tahunnya. Perbedaan yang dihasilkan dari hasil sintesis dan dari bahan
alami, seperti jeruk, terletak pada banyaknya zat lain selain vitamin C
yang terkandung dalam jeruk. Namun pada dasarnya, keduanya sama.
(Sumber: Chemistry (Mc Murry, J and Fay, R), 2001.)
Anda sekarang sudah mengetahui Asam Karboksilat. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Mudah dan Aktif Belajar Kimia 3 :
Untuk Kelas XII Sekolah Menengah Atas / Madrasah Aliyah. Pusat
Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 298.

 TV One - Berita Terkini
TV One - Berita Terkini














1 komentar:
saya asik dengerin ga jadi baca.. :)
Posting Komentar